施奇惠团队与合作者在《PNAS》报道新型肺癌循环肿瘤细胞表型
转移是癌症最重要的特征,也是导致癌症患者死亡的最主要原因。肿瘤细胞从原位病灶脱落并播散进入血液,形成远端转移的种子,而这一事件可发生在癌症的早期。在血液中检出循环肿瘤细胞(CTC)具有重要的临床价值,一方面可用于癌症诊断,因为完整的肿瘤细胞是肿瘤存在的高级别证据;另一方面也提示了癌症转移的可能。目前唯一获得FDA批准的CTC检测技术是CellSearch系统,被批准用于转移性乳腺癌、结肠癌与前列腺癌患者的CTC检测,但其在非小细胞肺癌(NSCLC)中检出率很低,这与NSCLC容易转移的临床经验不符,提示其采用的标志物可能无法有效检测NSCLC的CTC。CellSearch主要采用上皮标志物EpCAM和pan-CK(细胞角蛋白)来检测CTC,这也是大部分CTC检测技术所共同采用的标志物(可能前段样本处理与富集方法各异)。上皮标志物主要存在两个问题:一是难以检测不表达或低表达上皮标志物的CTC(灵敏度问题);二是上皮标志物非肿瘤细胞特有,而是所有上皮细胞所共有的,甚至在部分非上皮细胞中也可表达,因此难以确定检测到是否确为肿瘤细胞(特异性问题)。因为,一方面需寻找新的标志物解决NSCLC中CTC检出率低的问题,同时也应通过单细胞测序来验证所检测到的CTC并解析其分子特征以指导临床诊疗。
我院施奇惠研究团队与美国系统生物学研究所魏巍团队以及上海市胸科医院陆舜团队早在2017年就开始使用荧光标记的代谢标志物检测肺癌患者胸腔积液中的稀有肿瘤细胞,并通过单细胞测序验证标志物的可靠性,同时在患者层面证明其具有优于脱落细胞学的诊断灵敏度(Tang et al., PNAS 2017, 114, 2544-2549)。这一工作被曾提出Light标准的胸腔积液专家Richard Light在Faculty of 1000 Prime上推荐。该合作团队在2019年采用两种功能性的荧光标记代谢探针检测肺癌患者胸腔积液中的游离肿瘤细胞并对其分型,在基因组、转录组层面研究了不同代谢表型的肿瘤细胞的分子特征与临床意义(Li et al., Nat Commun. 2019, 3856)。由于血液样本的特殊性及保存、运输的需要,常需要对样本先固定后检测,因此团队引入了新的糖酵解密切相关的标志物己糖激酶2(HK2)用于NSCLC患者外周血中CTC的检测。这一工作以“Hexokinase 2 discerns a novel circulating tumor cell population associated with poor prognosis in lung cancer patients”为题已于近日发表于PNAS杂志上。

HK2作为一个与肿瘤Warburg效应密切相关的酶,可用于检测血液中高糖酵解活性的肿瘤细胞(在一定阈值下),因此是一个与上皮标志物相独立的功能标志物。这一标志物与CK联用可大幅提升III/IV期NSCLC患者外周血中CTC检出率至72%,其原因在于新标志物能够发现NSCLC患者血液中广泛存在的之前被忽略的CK阴性CTC,且在至少一半的患者中,这种CK阴性的CTC占据了主导地位(所有患者原位组织均为CK阳性),这部分解释了非小细胞肺癌CTC检出率低的问题。同时,这种CK阴性的脱落肿瘤细胞在NSCLC患者胸腔积液和脑脊液中也广泛存在,但相比于CK阳性的肿瘤细胞则占比很低,这点与外周血中不同。
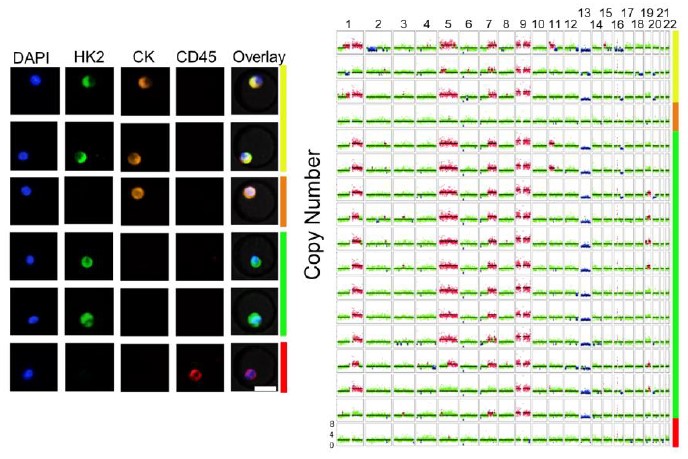
相比于CK+ CTC,CK- CTC的尺寸更小、变形能力增强。单细胞基因组测序表明CK-CTC与CK+ CTC有相同的全基因组拷贝数变异谱,揭示了它们相同的起源。转录组测序发现CK-CTC具有与转移、靶向药物耐药相关的分子特征,同时CK表达与CTC的EMT状态并无必然关系,颠覆了传统EMT理论中认为CK为上皮型细胞特征的观念。在未治疗的肺腺癌患者中,外周血中CK-CTC占据主导的患者对应了更差的疗效与更短的无进展生存期。该工作展示了NSCLC患者外周血中更全面的CTC表型,并揭示了其生物学意义和临床意义。
杨柳、Xiaowei Yan、陈婕、詹琼、华萤奇为该论文的共同第一作者。复旦大学生物医学研究院施奇惠研究员与美国系统生物学研究所魏巍、上海市胸科医院陆舜为共同通讯作者。
原文链接:https://doi.org/10.1073/pnas.2012228118