PNAS丨刘妍君/刘宝红合作团队揭示受限微环境中阿米巴样细胞迁移低耗能机制
细胞生存在一个复杂且动态的,由多种生物、化学和物理因素共同调控的微环境中。感知和响应外界微环境是生命活动的关键要素之一。在胚胎发育、器官成熟、组织再生修复、肿瘤发生发展等过程中,力学受限微环境无处不在,不同类型的生物力学刺激决定不同的细胞命运,进而影响整个生物体的功能和健康。因此,深入研究细胞在体内微环境中的真实行为及调控机制,对于理解生命活动的基本规律和探索疾病治疗方法具有重要意义。
为了模拟体内细胞所处的力学微环境,我们发展了一种微米尺度、精度可控的受限微环境重构系统,结合高分辨活细胞荧光动态成像技术,开创性地发现并揭示了肿瘤细胞在体内微环境中迁移的一种全新模式——在空间受限微环境(confinement)中,肿瘤细胞能够自发地改变其形态,由运动缓慢的间充质mesenchymal迁移转化为运动迅速的阿米巴样amoeboid迁移(Cell, 2015, 160, 659-672)。这一突破性研究成果证实:细胞迁移的动态可塑性是其在体内复杂的组织微环境中灵活适应的关键特性。细胞能量代谢活动与适应性细胞迁移模式的转变密切相关。值得注意的是,复杂微环境下自适应细胞迁移过程中,细胞的能量需求与细胞形态和细胞-胞外基质相互作用高度协调。然而,空间受限下细胞不同迁移模式的能量适应性特征仍不清晰。
2024年3月28日,复旦大学生物医学研究院刘妍君和复旦大学化学系刘宝红团队在PNAS发表题为“DNA nanomachines reveal an adaptive energy mode in confinement-induced amoeboid migrationpowered by polarized mitochondrial distribution”的研究论文,该研究中,通过设计构建功能性DNA纳米器件,旨在精准追踪线粒体和灵敏感应ATP,以此揭示不同机械力微环境下细胞迁移模式适应性能量策略。该团队通过对微环境黏附水平和物理受限的调控,成功诱导细胞迁移模式的转换。通过特异性线粒体实时追踪及ATP高灵敏测量,发现癌细胞在间充质细胞迁移模式下,表现出整个细胞广泛的线粒体分布,并在前缘和后缘进行战略性运输,以驱动细胞粘附依赖性运动。然而,受限诱导的癌细胞快速A2细胞迁移采用节能模式,线粒体在细胞运动后端高度极化分布,驱动细胞以一种较低能量消耗快速从限域的微环境中逃逸。

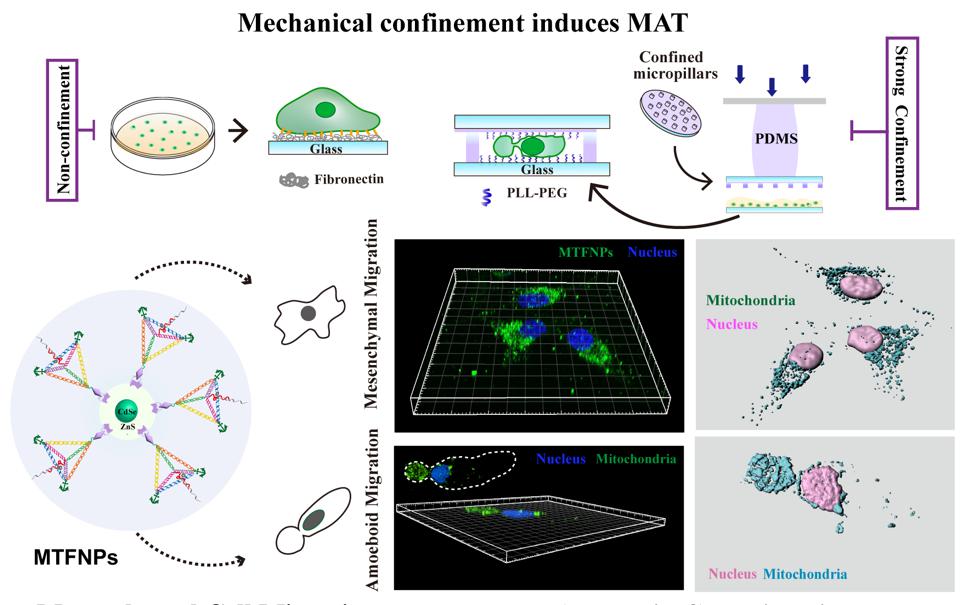
图1 受限诱导细胞不同迁移模式及线粒体的空间分布
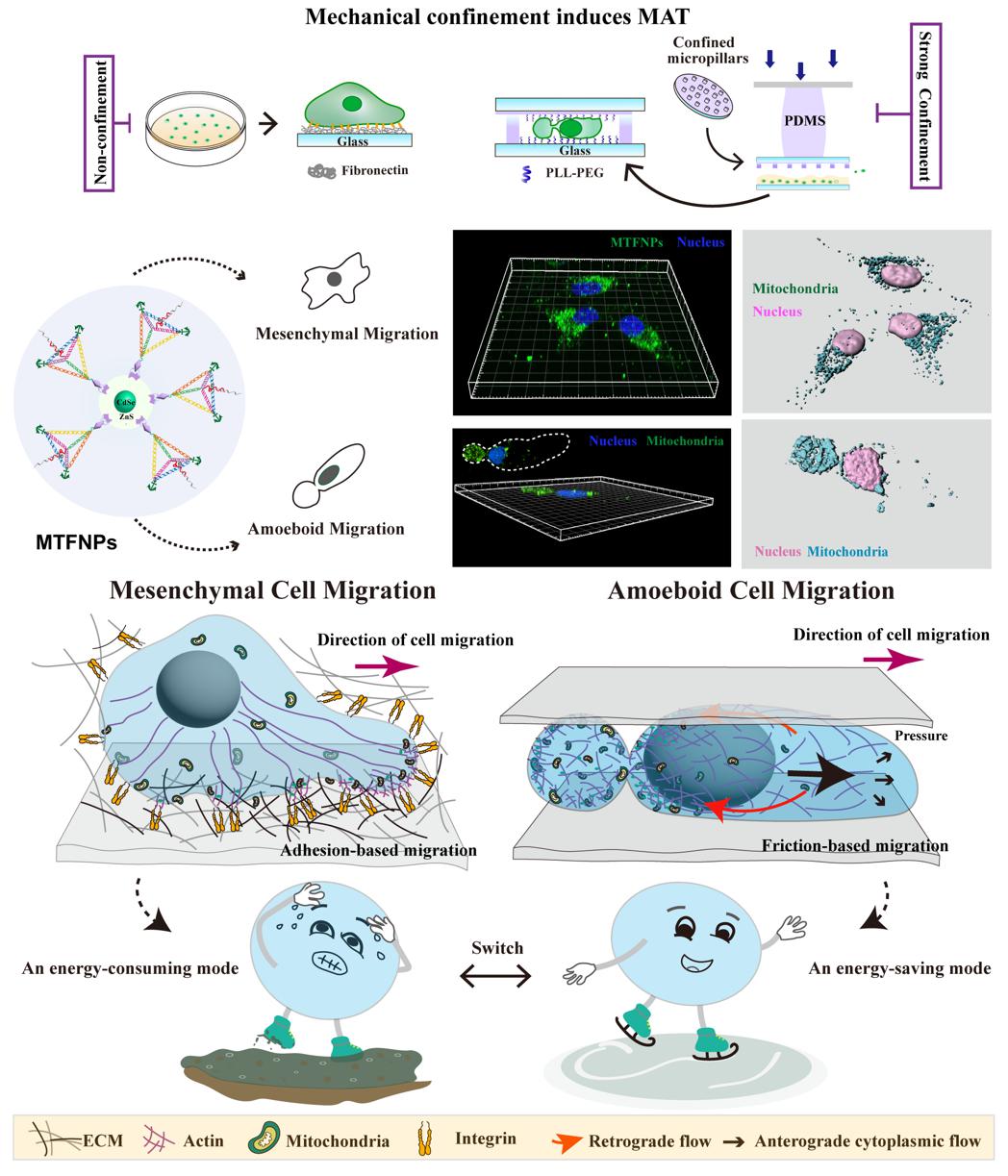
图2 受限诱导细胞不同迁移模式下的能量策略示意图
该研究有助于深入理解能量自调节和迁移模式如何共同协调,在面临机械力挤压下驱动有效的转移逃逸,为深入了解胚胎发育,免疫反应和癌症转移过程中的能量机制提供一个新的视角。
复旦大学生物医学研究院刘妍君教授及化学系刘宝红教授为本文共同通讯作者。复旦大学博士后柳懿芯和王亚君为本文第一、第二作者。该工作得到国家自然科学基金委、科技部、人类前沿科学计划(HFSP)及博士后科学基金等项目的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2317492121