Science丨打破传统认知:王磊团队揭开人类卵母细胞纺锤体组装之谜
纺锤体的正确组装是哺乳动物有丝分类和减数分裂顺利进行的关键事件,只有纺锤体的精确组装才能保证染色体的正确分离及后续细胞和胚胎的正常分裂及发育。人与小鼠体细胞的纺锤体组装由中心体(centrosome)介导,而人和小鼠卵母细胞中并不存在中心体。已有研究发现,小鼠卵母细胞的纺锤体由无中心粒的微管组织中心(acentriolar microtubule organizing centers, aMTOCs)介导形成。但自上世纪80年代开始,人卵母细胞中一直未观察到MTOC的存在,因此学术界长期以来的观点均认为人卵中不存在MTOC(Science,2015;Annu. Rev. Cell Dev. Biol, 2018)。那么人类卵母细胞纺锤体究竟是如何形成的?这一科学问题的答案一直未知。
2022年11月18日,复旦大学生物医学研究院王磊、桑庆团队联合复旦大学附属妇产科医院集爱遗传与不育诊疗中心孙晓溪团队在Science杂志上以长文(Research Article)形式发表题为 “The mechanism of acentrosomal spindle assembly in human oocytes”(《人类卵母细胞非中心体纺锤体组装的机制》) 的文章,发现人卵母细胞中存在着前所未知且与众不同的微管组织中心,研究者将其命名为huoMTOC(Human Oocyte Microtubule Organizing Center),明确了相关分子组成、阐明了人卵母细胞启动纺锤体组装的生理机制,最后在卵母细胞纺锤体组装异常患者中鉴定到huoMTOC组分的基因突变,从生理病理角度揭示了人卵母细胞纺锤体组装新机制。

值得一提的是,2016年王磊/桑庆团队明确了人卵母细胞成熟障碍为新孟德尔遗传病,发现了第一个致病基因TUBB8并揭示了病理机制(N Eng J Med,2016)。TUBB8为灵长类特异基因,构成人类卵母细胞纺锤体的主要成员。结合此次发现人卵母细胞中存在独特的huoMTOC与微管形成及纺锤体组装密切相关,这些证据表明:与其他哺乳动物相比,人卵母细胞在发育与进化中存在诸多独特之处。
首先,研究人员利用免疫荧光和高分辨成像技术对核膜破裂后的人卵母细胞进行观察,结果显示其形成的纺锤体微管主要聚集于染色体的动粒(kinetochore)位置。进而,通过活细胞实时三维成像技术(3D time-lapse imaging)详细记录了动粒起始微管组装的动态过程。由此推测,人卵母细胞动粒可能存在特殊的微管组织中心起始纺锤体微管聚合。随后,研究者在处于第一次减数分裂中期的人卵母细胞中,对86个主要的中心体或微管相关蛋白进行了定位分析,最终确定43个蛋白具有人卵母细胞纺锤体相关定位。其中,有四个蛋白(CCP110,CKAP5,DISC1 和 TACC3 )同时定位于动粒和微管,这与他们在有丝分裂过程中的定位截然不同。研究人员于是将上述四个蛋白在GV (Geminal vesical)期人卵母细胞中进行定位观察,另人意外的是,在GV期核膜附近这四个蛋白组成了一种此前从未被发现的特殊结构,同时在该结构周围观察到新生微管聚集,而在鼠、猪卵母细胞中并未观察到该结构。由于该结构在人卵母细胞中负责聚合微管,因此研究者将其命名为人卵母细胞微管组织中心(human oocyte microtubule organizing center,huoMTOC)。
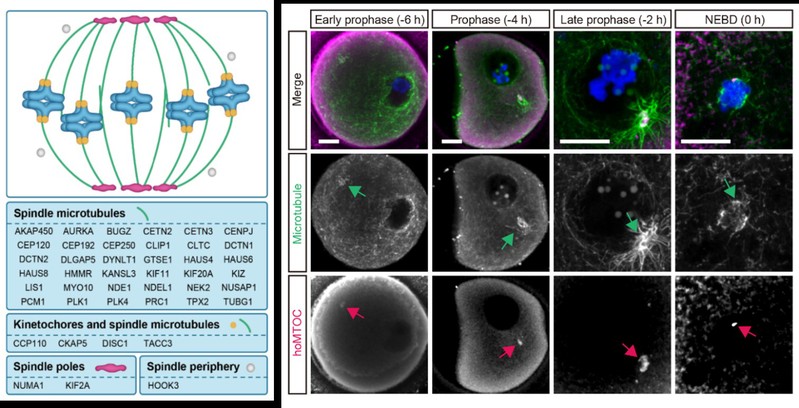
进一步,研究者利用活细胞追踪成像对此结构进行追踪,结果发现,huoMTOC形成于卵母细胞皮质区(cortex),并于NEBD(Nuclear envelope breakdown)之前迁移到核膜附近。随着NEBD的发生,huoMTOC开始碎裂并逐渐定位于动粒,同时在动粒附近起始纺锤体微管的聚集和生长。当huoMTOC结构被破坏时(通过激光烧蚀或下调主要成员蛋白水平),人卵母细胞中的纺锤体微管则会聚合受阻,最终导致无法形成纺锤体。上述结果表明,huoMTOC在人卵母细胞纺锤体组装过程中发挥重要作用。
最后,为了进一步确定huoMTOC是否具有临床意义,研究人员在1400余名卵母细胞成熟障碍患者的全外显子测序数据中进行突变筛查,结果发现两位患者携带TACC3的复杂合致病突变。免疫荧光检测发现,两位患者GV期卵母细胞的huoMTOC结构均被完全破坏,同时在MI期卵母细胞中均没有纺锤体形成。由此证实,huoMTOC异常将会直接导致女性卵母细胞成熟障碍。
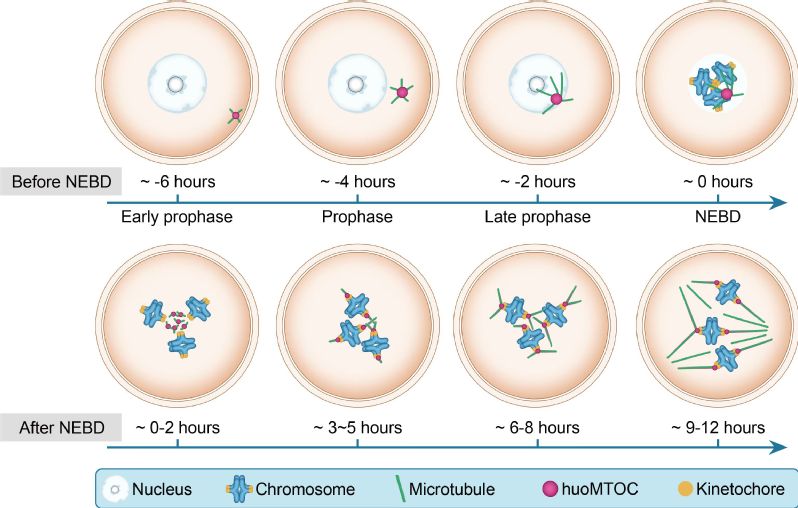
综上所述,研究人员首次发现了人卵母细胞中组装纺锤体微管的全新亚显微结构huoMTOC,并且阐明了huoMTOC调控人类卵母细胞纺锤体组装的独特生理机制,同时揭示了huoMTOC异常导致患者卵母细胞成熟障碍,为该疾病的病理机制贡献了新认识。
复旦大学生物医学研究院王磊、桑庆及上海集爱遗传与不育诊疗中心孙晓溪为通讯作者。复旦大学生物医学研究院武田宇、博士生董洁(已毕业)、上海集爱遗传与不育诊疗中心伏静、上海交通大学附属第九人民医院生殖中心匡延平为本文共同第一作者;此外,上海交通大学附属国际和平妇幼保健院李文、章美玲和复旦大学附属中山医院董曦也参与了该项研究。