Cell Metabolism丨储以微团队与合作者发现Foxp3通过代谢重编程提升CAR-T细胞抗实体瘤治疗疗效
嵌合抗原受体修饰T细胞(CAR-T)疗法已在血液系统肿瘤治疗中取得显著疗效,但其对实体瘤的临床应用仍面临重大挑战。CAR-T细胞依赖糖酵解和线粒体氧化磷酸化(OXPHOS)供能,极易受制于低糖、缺氧及乳酸蓄积的实体瘤微环境,陷入能量枯竭-功能耗竭的恶性循环。而调节性T细胞(Treg)因其独特的脂代谢优势可在实体瘤微环境中长期存活并发挥效应,为破解CAR-T细胞实体瘤治疗困局提供关键启示。
2025年5月5日,复旦大学生物医学研究院/基础医学院储以微教授、复旦大学附属华山医院骆菲菲研究员团队在Cell Metabolism发表题为Foxp3 confers long-term efficacy of chimeric antigen receptor-T cells via metabolic reprogramming的研究论文,首次揭示Foxp3通过非转录依赖的线粒体动态调控机制,重塑CAR-T细胞代谢表型,赋予其突破实体瘤微环境限制的生存优势,提升CAR-T细胞实体瘤治疗的持久性和有效性。这项研究为实体瘤免疫治疗提供了增效不增毒的创新解决方案。

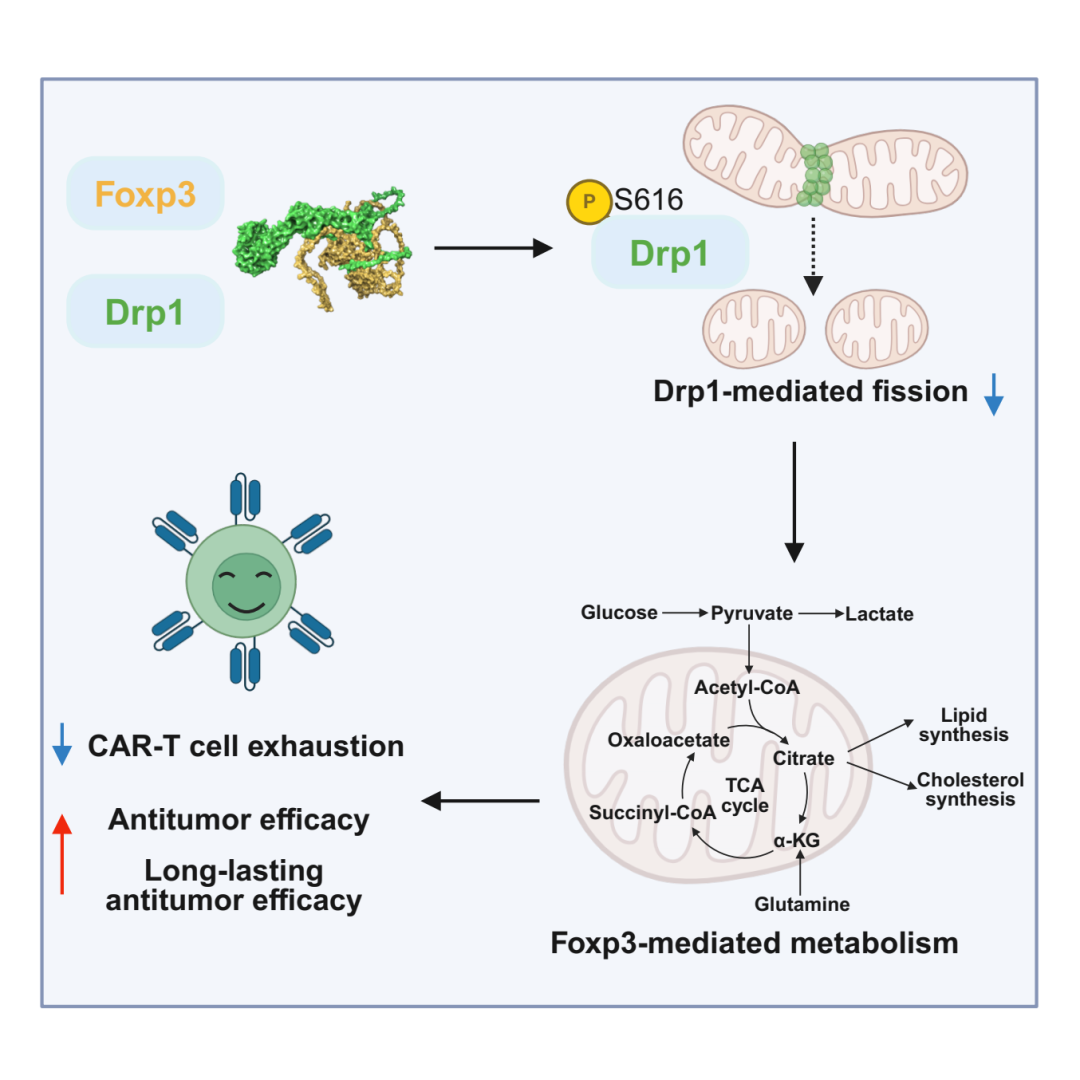
本研究构建了共表达Treg核心转录因子Foxp3的新型CAR-T细胞(CAR-TFoxp3),发现其与传统CAR-T细胞(CAR-TConv)相比,呈现糖酵解与OXPHOS活性显著下调,而脂代谢显著增强的代谢特征,且该特征与Treg高度相似。分子机制研究发现,Foxp3蛋白可通过核-线粒体转位机制,经其Forkhead结构域(340-390aa)与线粒体分裂动力蛋白Drp1的GTPase结构域(600-620aa)形成特异性互作,通过空间位阻效应抑制Drp1 Ser616磷酸化,导致线粒体超融合及OXPHOS效率下降,增强脂代谢活性,介导Treg样的代谢特征。值得注意的是,虽然CAR-TFoxp3细胞具有类Treg代谢表征,但CAR-TFoxp3细胞在Treg特征性免疫抑制基因座的染色质开放区域未呈现显著富集,且Tregs特异性转录因子基序在CAR-TFoxp3细胞的开放染色质区域中也未被显著识别。同时,CAR-TFoxp3细胞不表达CTLA-4、IL-10、TGF-β等免疫抑制性分子,也不具有免疫抑制性功能。体外功能实验发现,CAR-TFoxp3细胞展现出与CAR-TConv细胞等效的肿瘤特异性杀伤活性。但是,在应对肿瘤抗原多次刺激时,CAR-TFoxp3细胞相较于CAR-TConv细胞,展现出显著的抗耗竭表征,表现为PD-1、LAG-3、TIM-3等耗竭分子表达降低,CD62L、BCL-6等干细胞样记忆表型占比升高。且CAR-T Foxp3细胞这一抗耗竭表征依赖于Foxp3介导的OXPHOS下调及脂代谢增强等代谢特征。进一步体内移植瘤模型中发现,与CAR-TConv细胞相比,CAR-TFoxp3细胞显著抑制肿瘤生长,并有效抵抗二次母本肿瘤的攻击。肿瘤浸润CAR-TFoxp3细胞也呈现更低的耗竭表征和更高的干细胞样记忆表征。同样,CAR-TFoxp3细胞体内的抗肿瘤有效性和持久性也依赖于Foxp3介导的代谢重塑。进一步,在肿瘤-免疫双人源小鼠模型中,CAR-TFoxp3细胞仍可有效抑制肿瘤生长,实现了40%的完全缓解,而CAR-TConv细胞治疗组小鼠肿瘤均未见完全缓解。同时,CAR-TFoxp3细胞也未见对其它人源免疫细胞的功能抑制,并伴随较低的炎性细胞因子分泌水平。
综上所述,本研究通过解析Foxp3-Drp1轴调控的细胞代谢适应性机制,开创了实体瘤CAR-T疗法的“代谢赋能”新策略,兼具强效抗肿瘤与安全性优势,标志着肿瘤免疫治疗从传统“增强杀伤”向“重塑生存”的范式转变。
复旦大学附属华山医院骆菲菲研究员为本文的最后通讯作者,复旦大学生物医学研究院及基础医学院储以微教授为本文的共同通讯作者,复旦大学基础医学院牛聪义博士生为第一作者。
原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00218-9