Nat Cell Biol丨温文玉团队揭示氧化还原敏感的MBD2-NuRD凝聚体的促癌机制
在肿瘤发生发展过程中,抑癌基因启动子区的CpG岛常发生异常高甲基化修饰,进而通过招募DNA甲基化阅读器以强化转录沉默,导致细胞增殖失控并促进肿瘤进展。因此,靶向DNA甲基化阅读器以逆转基因沉默成为当前癌症治疗领域备受关注的研究方向。在多种DNA甲基化阅读器中,甲基化CpG结合域(MBD)蛋白家族发挥着关键作用。其中,MBD2不仅是核小体重塑和组蛋白去乙酰化酶(NuRD)复合体的核心组分,还具有特异性识别甲基化DNA的能力。临床研究表明,MBD2在神经胶质瘤、宫颈癌、胰腺癌等多种人类恶性肿瘤中普遍呈现高表达状态,且其表达水平与肿瘤的生长转移密切相关。然而,MBD2蛋白水平上调与肿瘤发生发展的病理学关联尚未完全阐明,MBD2如何通过整合NuRD复合体来调控肿瘤细胞的表观遗传特征也有待深入研究。
2025年4月30日,复旦大学生物医学研究院温文玉课题组在Nature Cell Biology杂志上发表了题为Targeting redox-sensitive MBD2–NuRD condensate in cancer cells的研究论文。该研究揭示了MBD2通过形成相分离凝聚体组装并激活NuRD复合物,进而阻遏抑癌基因转录以促进癌细胞增殖的分子机制,并为MBD2高表达肿瘤提供了基于氧化还原调控的靶向治疗策略。

研究团队首先观察到,内源性MBD2蛋白在多种癌细胞的细胞核中呈现明显的点状分布特征,而在正常细胞中这种点状结构显著减小。当以具有促氧化效应的临床药物Elesclomol或Nelfinavir处理肿瘤细胞后,MBD2的分布模式由点状转变为弥散状态,提示肿瘤细胞中高表达的MBD2所形成的点状结构具有氧化还原敏感性。进一步研究发现,MBD2可发生液-液相分离,且只有多甲基化修饰高CG含量的长片段DNA才能显著增强MBD2的相分离能力,这提示在高甲基化CpG岛屿上可能才会发生MBD2的有效凝聚。通过体外酶活实验结合H3K27ac ChIP-seq和ATAC-seq分析,研究证实MBD2相分离凝聚体能够组装并稳定NuRD复合物,显著激活NuRD复合物的去乙酰化酶和染色质重塑活性。在MBD2高表达的癌细胞中,MBD2-NuRD凝聚体特异性靶向异常高甲基化的抑癌基因启动子区域,通过压实染色质结构来抑制转录,从而促进癌细胞增殖。在MBD2相分离突变体(MBD2KRR/E)细胞中,染色质可及性明显增加,抑癌基因表达恢复正常,癌细胞增殖速率显著降低。
基于肿瘤细胞中MBD2凝聚体具有氧化还原敏感性这一发现,研究人员筛选确定了MBD2响应氧化还原变化的关键氨基酸位点Cys359。促氧化药物通过氧化Cys359,导致MBD2的氧化还原敏感结构域(RSD)发生去折叠,从而破坏了MBD2凝聚体的形成,最终抑制癌细胞增殖。而在氧化还原敏感突变体(MBD2C359/A)细胞中,促氧化药物抑制肿瘤细胞增殖的效应大大减弱。
综上所述,本研究系统阐明了在多种肿瘤中异常高表达的MBD2的作用机制:MBD2通过在肿瘤抑制因子启动子区域高甲基化CpG岛上形成相分离凝聚体,进而组装并激活NuRD复合物,通过组蛋白去乙酰化作用压实染色质结构以抑制转录,促进癌细胞增殖。促氧化剂类抗癌药物可以通过氧化MBD2 C359干扰其相分离,增加染色质开放性,上调抑癌基因表达,从而有效抑制肿瘤生长。这些结果提示,在单个氨基酸精度上特异性干预相分离过程,可能成为针对MBD2相关肿瘤的一种精准医疗策略。
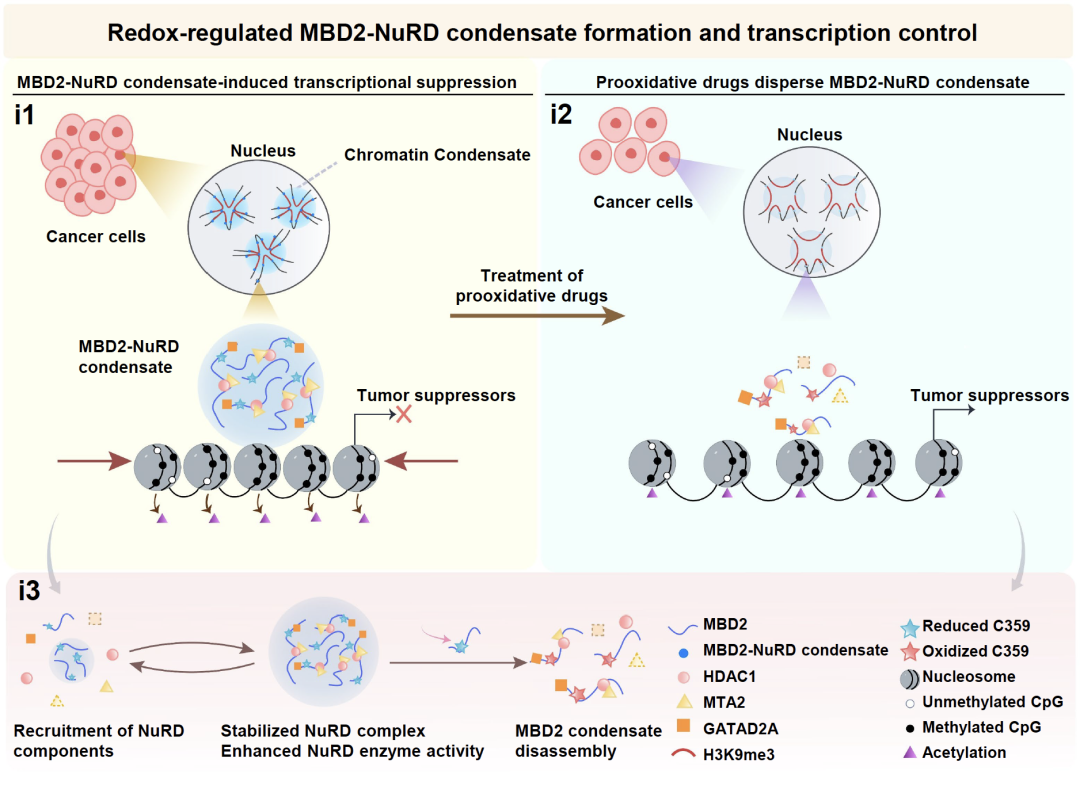
图1 氧化还原敏感的MBD2-NuRD凝聚体调控肿瘤进程
复旦大学博士生魏鹤旸为本文的第一作者,复旦大学温文玉研究员为本文的通讯作者。该研究与浙江大学胡荣贵研究员、复旦大学蓝斐研究员合作完成。复旦大学郑洪丹博士生、王司清博士、赵睿倩博士、顾爱红博士,以及国科大杭州高等研究院杨云博士对本文亦有贡献。
原文链接:https://www.nature.com/articles/s41556-025-01657-2