Advanced Science丨郭睿等报道染色质结合蛋白RACK7通过结合PRC2复合体调控脑发育的表观遗传机制
在脑发育以及神经系统疾病中,表观遗传调控机制扮演着关键角色。RACK7(又称ZMYND8),是一个重要的组蛋白修饰识别蛋白,能够特异性识别H3.1K36me2-H4K16ac以及H3K4me1-H3K14ac等组蛋白双修饰。包括本研究团队在内的多项研究表明,RACK7在肿瘤发生和神经细胞中具有重要作用,此外,智力障碍等神经发育疾病患者中也检测到RACK7突变,这些都暗示了RACK7在神经系统发育中的潜在作用。但是,目前的相关研究仅局限于细胞水平,神经系统中RACK7的生物学功能及其分子机制仍有待阐明。
2025年3月24日,复旦大学生物医学院郭睿团队在Advanced Science杂志在线发表题为RACK7 Interacts with PRC2 Complex to Regulate Astrocyte Development的研究论文。该研究首次揭示了表观遗传“阅读器”蛋白RACK7如何通过与PRC2复合体相互作用,调控H3K27me3修饰的染色质分布,影响星形胶质细胞的发育,并参与神经发育疾病的病理过程。这项研究不仅填补了RACK7体内功能的空白,还为理解神经发育类疾病的发病机制研究提供了新视角。

研究团队构建了RACK7条件性敲除小鼠模型,在小鼠的皮质以及海马特异性的敲除Rack7,发现RACK7缺陷小鼠表现出明显的发育障碍表型,包括体型和脑体积减小,运动协调障碍、焦虑样行为,自发性癫痫以及存活率降低等,单细胞转录组显示这些发育异常与星形胶质细胞发育紊乱相关。
机制上,研究团队发现RACK7与组蛋白H3K27me3修饰的甲基转移酶——多梳抑制复合体2(PRC2)相互作用,共同调控SUZ12以及H3K27me3修饰的染色质分布。在星形胶质细胞中敲除RACK7会导致全基因组范围内H3K27me3修饰在染色质上的分布减少。在此基础上,RACK7与H3K27me3协同作用,防止Wnt配体以及其他星形胶质细胞分化基因的过度激活,扰乱星形胶质细胞与其他神经细胞间的细胞通讯以及发育过程。
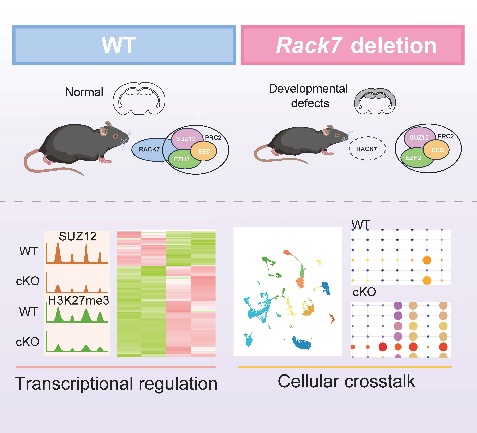
总之,此研究首次在体内阐明了RACK7通过与PRC2复合体的协同作用调控大脑发育的表观遗传机制,不仅深化了我们对脑发育调控机制的理解,也为神经发育类疾病的治疗策略开发提供了新的理论基础。
该论文的第一作者为复旦大学生物医学研究院博士后焦芳芳(现就职于上海交通大学医学院附属第九人民医院),通讯作者为复旦大学生物医学研究院郭睿副研究员。本论文得到牛津大学施扬教授、复旦大学石雨江教授的大力支持和帮助。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/advs.202416350