Nature Chemistry | 顾宏周课题组与合作者开发MORAC技术用于发现低丰度区的生物标志物
生物标志物是信息型分子、颗粒甚至于细胞,其在健康和病患人群间存在数量或质量上的明显差异。因此,生物标志物的发现和鉴定对于疾病的诊治具有重要的意义。但是,生物体系的高度复杂性及(疾病早期阶段)标志物的稀有性使得标志物的发现极具挑战。当前,以蛋白质组学为代表的组学类发现策略具有高通量的优点,而传统的基于亲和识别的生化类发现策略拥有较好的特异性,但两者均存在灵敏度不足的缺陷,难以在低丰度区高效地发现生物标志物,制约了我们对重大疾病发生发展过程中分子层面变化的深刻认知。
2023年9月15日,复旦大学生物医学研究院顾宏周研究组与复旦大学附属肿瘤医院江一舟研究组、复旦大学附属中山医院钟芸诗研究组合作在Nature Chemistry期刊上发表了文章“DNAzyme-based faithful probing and pulldown to identify candidate biomarkers of low abundance”,报道了一种全新的发现生物标志物的策略MORAC(MOlecular Recognition based on Affinity and Catalysis)。研究者基于DNA核酶(DNAzyme)易编辑且具备信号放大功能的特性,借助试管内高效进化技术,筛选获得高灵敏特异识别疾病样本的别构型DNA核酶探针,并将其突变后用作稳定的抓手分离、富集和鉴定所识别的分子(图1),从而为低丰度区的生物标志物发现带来了突破。

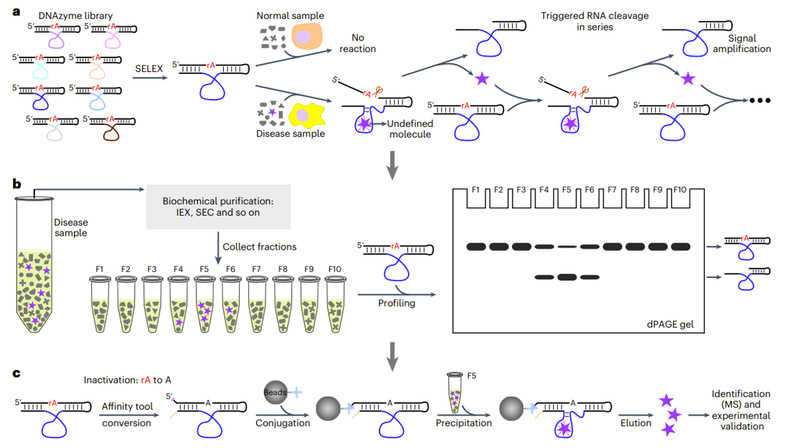
图1:基于DNA核酶的MORAC技术基本原理
利用MORAC策略,作者首先发现相较于正常乳腺上皮细胞系,在乳腺癌细胞系MDA-MB-231及其衍生型中,一类胞内的载脂蛋白APOL6异常存在于胞外代谢物里(图2)。APOL6的生物学功能目前未知,但其在乳腺癌中表达水平极低(底部25%范围内)。进一步的研究表明在乳腺癌中,APOL6是一个抑癌基因,基于Kaplan Meier分析的临床数据显示APOL6高表达的患者具备明显更高的存活率;并且在胰腺癌、卵巢癌、肺癌、肝癌和胃癌患者中,APOL6高表达也显示对应于更高的存活率。因此,APOL6具备作为泛癌种预后生物标志物的潜力。至于APOL6如何从乳腺癌细胞中跑到细胞外,还有待后续工作进一步解答。
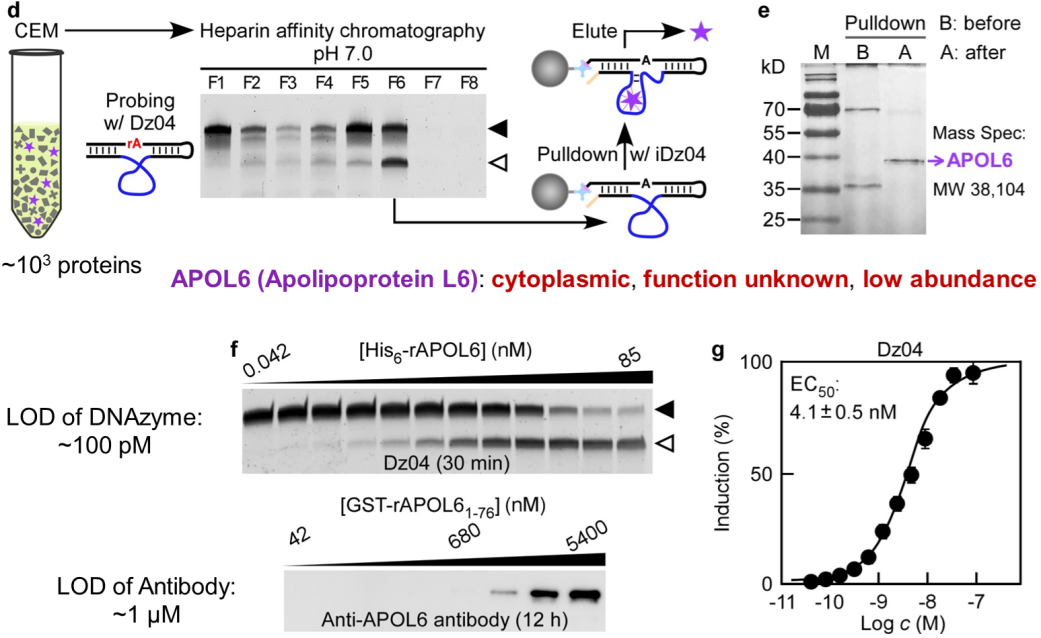
图2:利用MORAC鉴定APOL6作为乳腺癌的候选生物标志物之一
随后,作者在肠道低级别上皮内瘤变(Low-Grade Intraepithelial Neoplasia,LGIN,癌前病变)临床组织样本上验证了MORAC策略的通用性,发现一类tRNA连接酶SARS1(低丰度区蛋白)在瘤内10倍以上的异常高表达(相较于病灶旁的正常组织)(图3)。有意思的是,在所有(24例)肠道上皮内瘤变受试者中,无论瘤变级别高低,作者均检测到了明显的SARS1异常高表达;而在所有的(10例)肠癌受试者中,SARS1的表达不具备统计学意义上的明显差异。这些数据显示了SARS1作为肠癌癌前生物标志物的潜力。
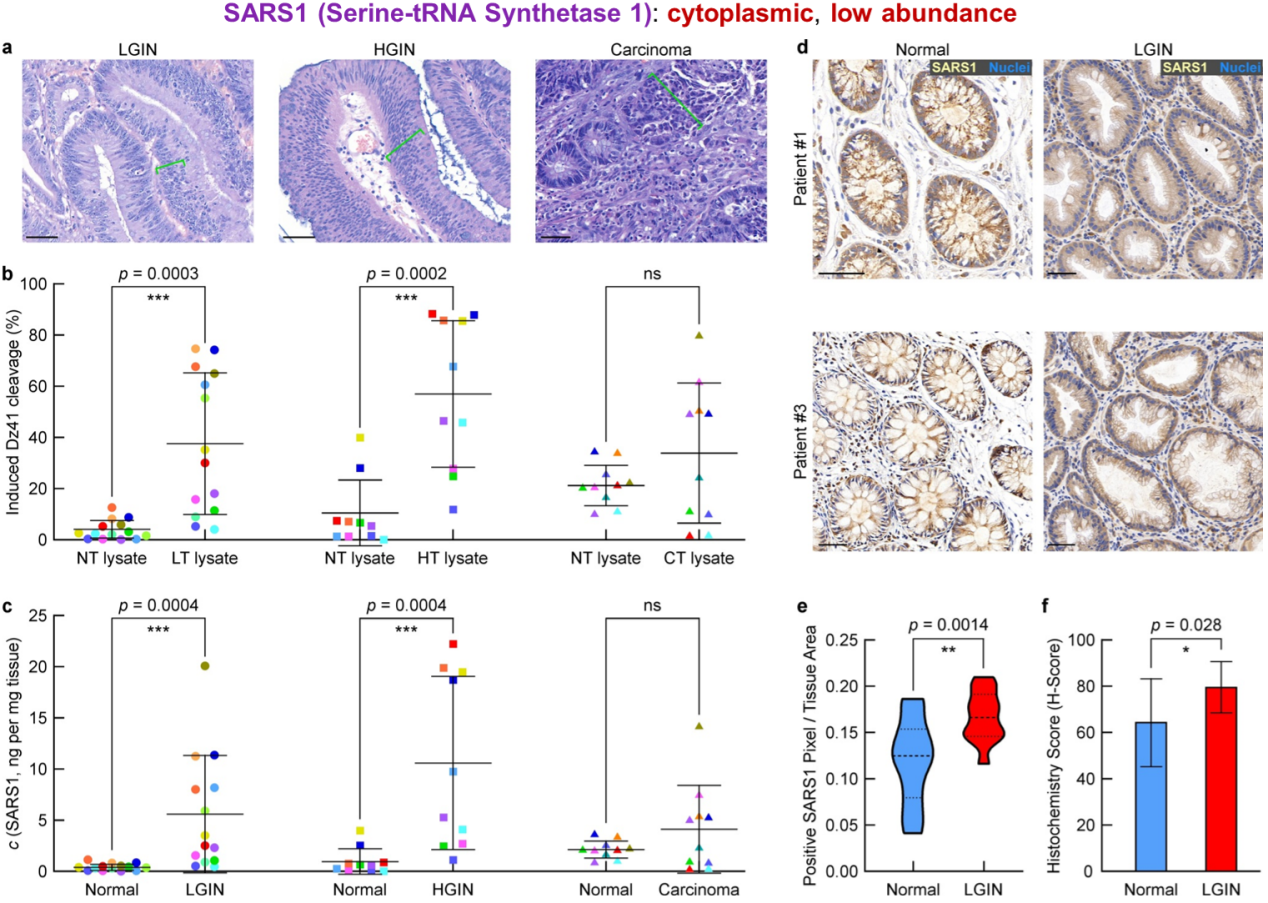
图3:利用MORAC鉴定SARS1作为结肠癌前息肉的候选生物标志物之一
作为方法学之间的对比,作者同步尝试了利用蛋白质组学技术分析生物样本,但测试结果难以给出APOL6或SARS1在疾病和正常样本间存在显著差异的结论;同时,利用抗APOL6或抗SARS1的抗体,作者比较了MORAC中的DNA核酶元件的靶标识别灵敏度,发现DNA核酶比抗体普遍具有2-4个数量级的检测下限优势。综上,作者认为MORAC策略可以作为传统生物化学和组学策略的有益补充,特别是在低丰度区用于生物标志物的高效发现。
据悉,复旦大学生物医学研究院和附属口腔医院顾宏周教授(现任职于上海交通大学化学化工学院)、复旦大学附属肿瘤医院江一舟教授及复旦大学附属中山医院钟芸诗教授为本文的共同通讯作者。胡沁沁(复旦大学/上海交通大学医学院)、佟宗轩(复旦大学)、阿依木克地斯·亚力孔(复旦大学)、葛丽萍(复旦大学)为本文共同第一作者。樊春海教授(上海交通大学)、刘杰教授(复旦大学)、叶丹教授(复旦大学)等为本工作的顺利开展提供了重要的支持。
原文链接:https://www.nature.com/articles/s41557-023-01328-5