我院徐彦辉课题组在Cell Research报道人源SRCAP复合物冷冻电镜结构
在真核生物体内,基因组DNA包裹着组蛋白八聚体形成高度浓缩的染色质以保持结构与功能的完整性。基因组相关的所有时间几乎都是在以核小体为单位的染色质层面发生的。包含组蛋白变体H2A.Z的核小体主要存在于基因启动子、着丝粒和染色质周围。H2A.Z核小体与常规核小体之间的快速置换对于基因表达、DNA修复和染色体稳定具有重要意义。人体中的H2A.Z置入到染色质上是依赖于SRCAP复合体(SRCAP-C),其酵母来源的同源物为Swr1复合物(Swr1-C)。SRCAP能够协助H2A.Z/H2B二聚体逐步替换常规核小体中的H2A/H2B二聚体,以实现H2A.Z的置入(deposit)。关于Swr1-C/SRCAP-C蛋白的功能研究已经很深入了,但是相关的结构研究非常有限,极大地阻碍了对其发挥动态功能的理解。

10月18日,徐彦辉课题组的研究人员克服了实验样本制备,结构解析等难题,利用中国科学院生物物理研究所以及国家蛋白质科学中心(上海)冷冻电镜设施,首次解析了4埃分辨率的人源SRCAP复合物冷冻电镜结构(下图),该项工作于近日以Cryo-EM structure of human SRCAP complex为题在线发表于《Cell Research》(细胞研究)杂志上。
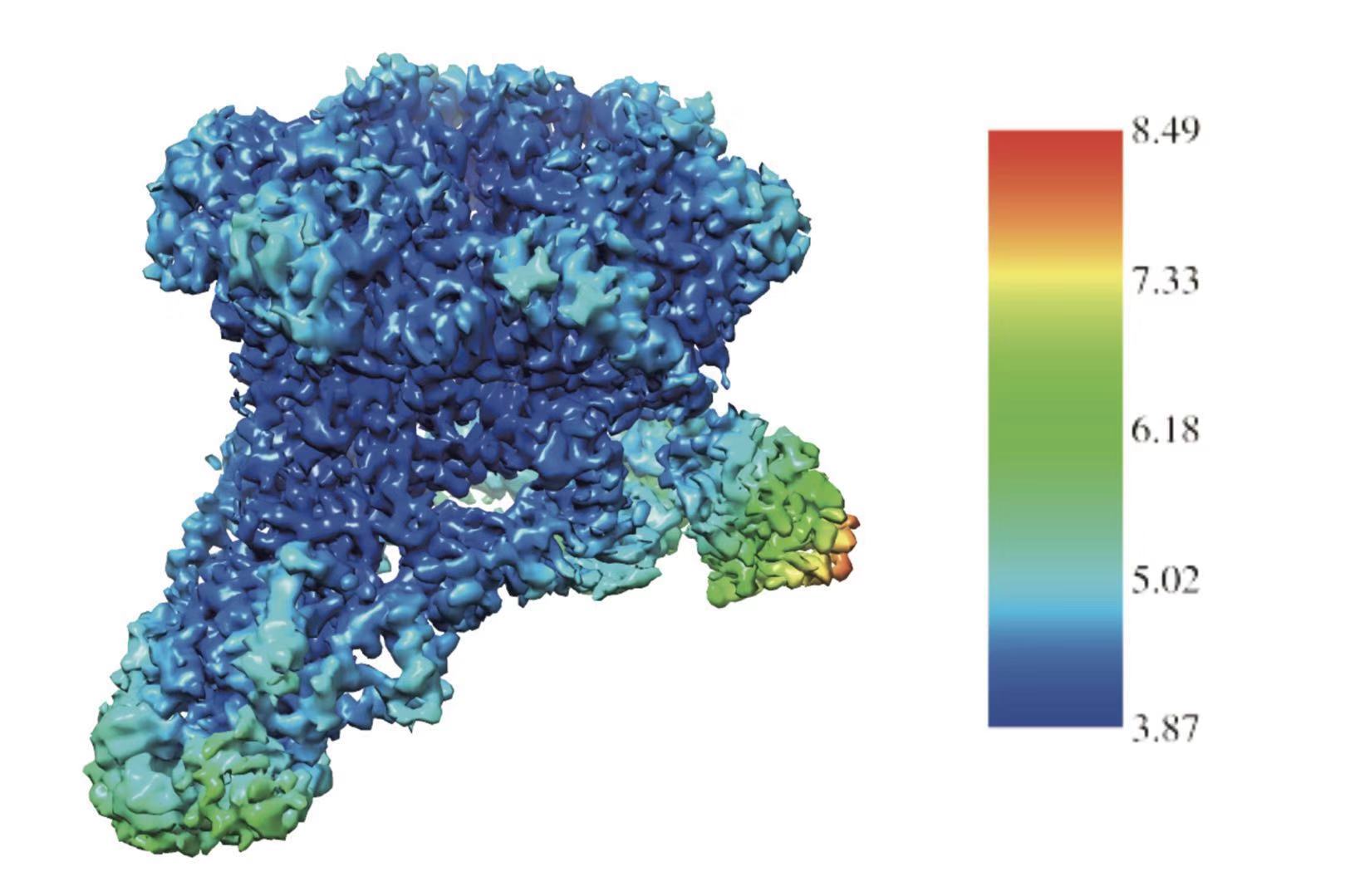
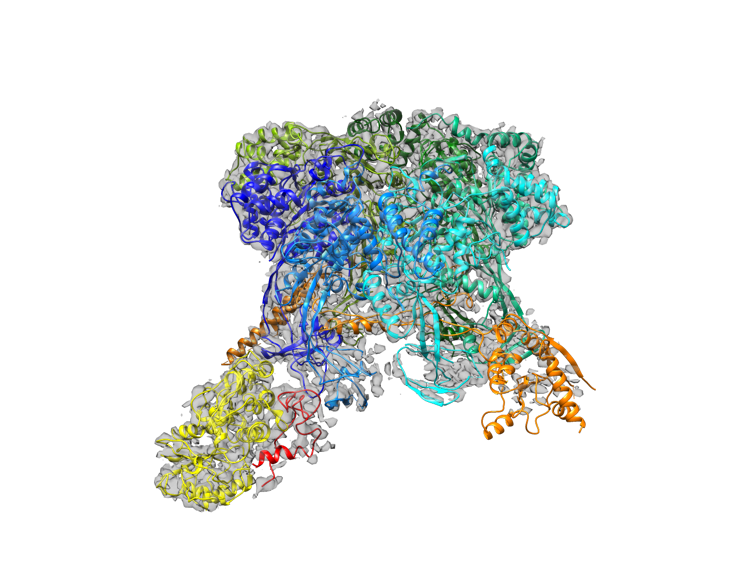
图:SRCAP复合物的冷冻电镜结构示意图。
SRCAP-C为超大复合物,分子量约为1 MDa(1000KDa),包含10个组分。结构和生化研究表明在SRCAP-C中SRCAP不仅具有ATP解旋酶酶活性,还作为支架蛋白帮助复合物组装。其中间部分贯穿RUVBL1-RUVBL2六聚体,其N端和C端分别连接多个SRCAP复合物组成蛋白。 RUVBL1-RUVBL2形成的六聚体为稳定核心,从底部两侧延伸出来SRCAP解旋酶结构域及Actin相关蛋白等模块。这两个相对应的模块具有DNA结合的表面特征,很可能为核小体结合位点。研究工作根据SRCAP同家族蛋白INO80与核小体复合物的结构,模拟了SRCAP与核小体相互作用方式,为后续深入研究核小体置换机制奠定了基础。
该项工作是复旦大学徐彦辉课题组完成,得到了科技部重点研发计划、中科院先导专项和国家自然科学基金的支持。国家蛋白质设施(上海)、中科院生物物理所电镜平台对该工作给予了重要的支持。
论文链接:https://www.nature.com/articles/s41422-018-0102-y